Archaea
Les Archées ou Archæa forment un groupe de micro-organismes unicellulaires et sont un groupe majeur de procaryotes. Comme les bactéries, elles ne présentent par conséquent ni de noyau, ni d'organites intracellulaires.
Recherche sur Google Images :
Source image : web.mit.edu Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ou Archées. Vie dans des milieux extrêmes aquatiques ou terrestres (en.... en 2 groupes : les Archées ou Archæa ou Archébactéries (les plus anciennes... (source : pagesperso-orange)
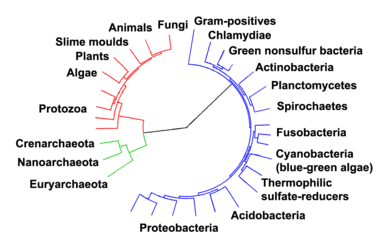
Les Archées ou Archæa (anciennement archéobactéries ou bien toujours archébactéries, du grec archaios, «ancien» et backterion, «bâton») forment un groupe de micro-organismes unicellulaires et sont un groupe majeur de procaryotes. Comme les bactéries, elles ne présentent par conséquent ni de noyau, ni d'organites intracellulaires. Avant les travaux de phylogénie, les Archæa, qui étaient toujours nommées archéobactéries, faisaient partie du règne des monères dans la classification à cinq Règnes du vivant. Les analyses plus détaillées ont montré que les archées étaient aussi différentes des Bactéries que celles-ci le sont des Eucaryotes : ces travaux aboutirent à la classification du vivant en trois domaines. Les Archæa ont été ultérieurement divisées en quatre phylum, dont les deux groupes des Crenarchæota et des Euryarchæota qui sont les plus étudiés.
Généralement, la taille et la forme des archées sont identiques à celles des bactéries, quoique certaines espèces d'archées présentent une forme inhabituelle, comme Haloquadra walsbyi qui est de forme plate et carrée. En dépit de ces similarités visuelles avec les bactéries, les archées s'en distinguent par certains caractères biochimiques, comme la constitution de la membrane cellulaire. Qui plus est , elles présentent des gènes et des voies métaboliques qui sont plus identiques à ceux qui sont rencontré chez les eucaryotes, surtout les enzymes impliquées dans le mécanisme de réplication de l'ADN, la et la traduction. Les archées utilisent une plus grande variété de source d'énergie que les eucaryotes : composé organique comme les sucres, l'ammoniac, les ions métalliques et même l'hydrogène gazeux comme nutriments. Les Halobacteria utilisent la lumière solaire comme source d'énergie, et certaines espèces d'archées peuvent fixer le carbone, cependant, à l'inverse des plantes et des cyanobactéries, il n'y a pas d'espèces d'archées connues capables de réaliser ces deux phénomènes. Les Archæa se reproduisent de manière asexuée et se divisent par fission binaire, fragmentation ou bourgeonnement. Par opposition aux bactéries ainsi qu'aux eucaryotes, aucune espèce d'archées identifiée à ce jour n'est capable de former des spores.
Les Archæa sont extrêmement diversifiées. Certaines sont connues pour leur capacité à vivre dans des conditions extrêmes et occupent des niches écologiques qu'elles sont fréquemment seules à occuper (pH proche de 0, température supérieure à 100°C, salinité élevée par exemple), mais il existe énormément d'archées vivant dans des biotopes plus courants et particulièrement variés comme le sol, les lacs, la mer ou l'intestin des animaux. Elles contribueraient jusqu'à 20% du total de la biomasse [1]. Ces procaryotes sont désormais ainsi reconnus comme une part majeure du vivant sur Terre, ils peuvent jouer un rôle dans le cycle du carbone et le cycle de l'azote. Il n'y a pas d'exemple clairement reconnu d'archées pathogènes ou parasites, mais il existe des espèces mutualistes ou commensales. A titre d'exemple, les archées méthanogènes du tractus intestinal de l'Homme et des ruminants participent à la digestion des aliments. Les archées ont aussi une importance en technologie, avec par exemple l'utilisation des méthanogènes pour produire des biogaz ou leur participation au traitement des eaux usées. D'autre part, les enzymes des archées extrémophiles, résistantes aux températures élevées ainsi qu'aux solvants organiques, sont exploitées en biotechnologie.
Au début du 20e siècle, les procaryotes étaient reconnus comme un seul groupe d'organismes et classées selon leur biochimie, de leur morphologie et du métabolisme. A titre d'exemple, les microbiologistes essayaient de classer les micro-organismes sur la base des structures de leurs parois cellulaires, leurs formes, et les substances qu'ils consomment. Cependant, une nouvelle approche a été proposée en 1965 qui permet d'étudier les liens de parentés entre les procaryotes en utilisant les séquences des gènes de ces organismes. Cette approche, connue sous le nom de la phylogénétique, est la principale méthode utilisée actuellement.
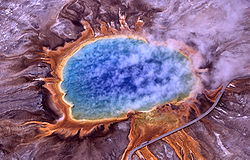
Les Archæa ont en premier lieu été classées comme un groupe différent des procaryotes en 1977 par Carl Wœse (professeur à l'Université de l'Illinois à Urbana aux États-Unis) et George E. Fox dans les arbres phylogénétiques basées sur les séquences de l'ARN ribosomal 16S (ARNr) des gènes[2]. Ces deux groupes ont été originellement appelé le Eubactéries et Archæobactéries et traités comme sous-règne ou règne. Wœse fait valoir que ce groupe de procaryotes est principalement différent des bactéries. Pour souligner cette différence, et pour insister sur le fait qu'ils composent avec les eucaryotes trois domaines bien différents du vivant, ces deux domaines ont plus tard été renommé Archeæ et Bacteria[3]. Le mot archées vient du grec ancien ἀρχαῖα, qui veut dire «choses anciennes».
Tout d'abord, seuls les méthanogènes ont été positionnés dans ce nouveau domaine, et les archées ont été reconnues comme des extrêmophiles qui n'existent que dans les habitats tels que les sources chaudes et les lacs salés. À la fin du 20e siècle, les microbiologistes se sont rendu compte que les archées sont en fait un grand groupe diversifié d'organismes qui sont particulièrement répandues dans la nature et qui sont communs dans une diversité d'habitats, tels que les sols et les océans[4]. Cette nouvelle appréciation de l'importance et de l'ubiquité des archées a été rendu envisageable grâce à la réaction en chaîne par polymérase pour détecter les procaryotes dans des échantillons d'eau ou de sol à partir de leurs acides nucléiques. Cela permet la détection et l'identification d'organismes qui ne peuvent pas être cultivés en laboratoire, ou dont la culture est complexe[5][6].
Classification actuelle
Ces organismes ont longtemps été regroupés sous le terme générique de procaryotes, avec les bactéries. Pour les différencier, les microbiologistes avaient élaboré un dispositif de comparaison et de classification fondé sur de petites différences visibles au microscope, mais aussi sur des différences physiologiques (capacité à se développer sur un certain milieu par exemple).
Dès qu'il s'est agi d'élucider les relations généalogiques entre les différents procaryotes, les biologistes ont dû se rendre à l'évidence : les différences nutritionnelles et phénotypiques ne permettraient pas de classer correctement les différents organismes. Au cours des années 1970, les biologistes ont pris conscience de l'existence irremplaçable d'information, au cœur même des cellules des êtres vivants, servant à déterminer la phylogénie, l'ADN. Le gène identifié dans une cellule est le variant d'un gène qui a existé il y a de particulièrement nombreuses années. La comparaison gène à gène entre deux organismes permet par conséquent de mesurer le temps écoulé depuis la divergence à partir de l'ancêtre commun.
Carl Wœse a réalisé que l'ARN ribosomique (ou ARNr, une des molécules contenues dans la cellule) des organismes qu'il étudiait permettait de mettre en évidence l'existence de deux groupes clairement scindés : les bactéries et les archéobactéries. En réalité, Wœse s'est aussi rendu compte que les ARNr des archées étaient en fait aussi différents des ARNr des bactéries que de celui des eucaryotes. Il en a conclu qu'il ne fallait plus seulement séparer en deux grands groupes le monde du vivant, selon la présence ou de l'absence d'un noyau, mais plutôt en trois domaines primitifs : les bactéries, les archées et les eucaryotes.
Aujourd'hui, de nombreuses études ont confirmé le caractère monophylétique de ce groupe. Ces microorganismes ressemblent par leur forme aux bactéries, mais d'un point de vue moléculaire, si certains de leurs traits les rapprochent des bactéries, d'autres les rapprochent plutôt des eucaryotes. Il n'est par conséquent pas envisageable de voir les archées comme étant des ancêtres des bactéries.
Le classement des archées, et des procaryotes généralement, est à la fois en évolution rapide et un domaine litigieux. Les dispositifs de classification actuelles visent à'organiser les archées en groupes d'organismes qui partagent des caractéristiques structurelles et des ancêtres communs[7]. Ces classifications s'appuient fortement sur l'usage de la séquence des gènes de l'ARN ribosomal pour révéler les relations entre les organismes (phylogénétique moléculaire) [8]. La majorité des archées cultivables sont membres de deux principaux embranchements : Euryarchæota et Crenarchæota. D'autres groupes ont été provisoirement créé. A titre d'exemple, les espèces propres Nanoarchæum equitans, qui a été découvert en 2003, a été classé dans un nouveau phylum : Nanoarchæota [9]. Un nouveau phylum Korarchæota a aussi été proposé, il contient un petit groupe d'espèces thermophiles inhabituels qui partagent les caractéristiques des deux principaux embranchements, mais qui est plus étroitement liée aux Crenarchæota [10][11]. Il y a peu de temps mises en évidence, d'autres espèces d'archées sont uniquement de loin lié à aucun de ces groupes, tels que les Archæal Richmond Mine Acidophilic Nanoorganisms (ARMAN), qui ont été découvertes en 2006 [12].
Origine et évolution
Bien que les fossiles connues de cellules procaryotes ont été datés de près de 3, 5 milliards d'années, la majorité des procaryotes n'ont pas de morphologies différentives et les formes des fossiles ne peuvent pas être utilisées pour les identifier comme étant des Archæa[14]. Par contre, les fossiles chimiques, sous la forme des lipides caractéristiques des archées, donnent plus d'informations, car ces composés n'existent pas dans d'autres groupes d'organismes[15]. Certaines publications ont suggéré que des lipides fossiles provenant de procaryotes ou d'eucaryotes étaient présents dans les schistes datant de 2, 7 milliards d'années[16], ces données ont depuis cependant été soumises à question[17]. Ces lipides ont aussi été détectés dans les roches datant du précambrien. Les plus anciennes traces connues de ces lipides isopréniques proviennent des roches de la formation d'Isua à l'ouest du Grœnland, qui comprennent des sédiments constitués il y a 3, 8 milliards d'années et qui sont les plus anciens sur Terre[18].
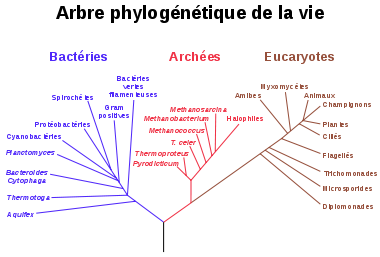
Wœse propose que les bactéries, les archées et les eucaryotes représentent chacune une lignée scindée qui aurait divergé à partir d'une colonie d'organismes ancestrale [19][20]. D'autres biologistes, cependant, ont fait valoir que les archées et les eucaryotes proviennent d'un groupe de bactéries[21]. Il est envisageable que le dernier ancêtre commun des bactéries et des archées soit un organisme thermophile, ce qui soulève la possibilité que la vie soit apparue dans des conditions de températures élevées[22]. Cette hypothèse n'est cependant pas accepté par la totalité de la communauté scientifique[23] [24]. D'autre part, dans la mesure où les archées et les bactéries ne sont pas plus liées entre elles qu'elles ne le sont des cellules eucaryotes, cela conduit à l'argument selon lequel le terme procaryote a pas de véritable signification évolutive et devrait être entièrement rejeté [25].
La relation entre les archées et les eucaryotes reste une problématique importante. En plus des similitudes dans la structure cellulaire et les mécanismes biochimiques qui sont discutés ci-dessous, de nombreux arbres phylogénétiques groupent les archées et les eucaryotes ensemble. Certaines des premières analyses ont même suggéré que la relation entre les eucaryotes et les archées de l'embranchement Euryarchæota est plus proche que la relation entre les embranchements Euryarchæota et Crenarchæota[26]. Cependant, il est désormais reconnu comme plus probable que l'ancêtre des eucaryotes a divergé tôt à partir de l'ancêtre commun avec les Archæa[27][28]. La découverte de gènes provenant d'archées dans le génome de certaines bactéries, telles que Thermotoga maritima, rend les relations entre organismes toujours plus complexes à déterminer, dans la mesure où le transfert horizontal de gènes a eu lieu [29]. Les gènes archéens dans les génomes eucaryotes pourraient aussi provenir de transfert horizontal. Certains auteurs suggèrent que les eucaryotes se soit développé à partir d'une fusion entre des bactéries et des archées (théorie endosymbiotique) [30].
Génome et Génétique
Les Archæa ont le plus souvent un seul chromosome circulaire. Le plus grand génome archéen séquencé à ce jour est celui de Methanosarcina acetivorans[31] avec 5 751 492 paires de bases tandis que le génome de Nanoarchæum equitans, le plus petit séquencé à ce jour fait un dixième de cette taille avec uniquement 490 885 paires de base. Il est estimé que le génome de Nanoarchæum equitans comporte 537 gènes codant des protéines[32]. Les éléments extrachromosomiques, nommés plasmides sont aussi présents dans archées. Ces plasmides peuvent être transférés entre les cellules par contact physique, dans un processus qui pourrait être comparable à la conjugaison bactérienne[33][34].
Reproduction
La reproduction des archæa a lieu de manière asexuée par division binaire, par fission multiple ou par fragmentation. La méiose ne se produit pas, l'ensemble des descendants ont le même matériel génétique. Après la réplication de l'ADN les chromosomes sont scindés et la cellule se divise[35]. Les détails du cycle cellulaire des archées ont fait l'objet de quelques études dans le genre Sulfolobus. Ce cycle a des caractères qui sont identiques à la fois des dispositifs eucaryotes et bactériens. Selon les espèces d'archées, les chromosomes sont répliqués à partir d'un ou plusieurs points de départ (origines de réplication) avec ADN polymérases qui ressemblent aux enzymes équivalentes des eucaryotes[36]. Cependant, les protéines de la division cellulaire, tels que la protéine FtsZ, qui forme un anneau contractant autour de la cellule, et les composants de la cloison naissante dans le cœur de la cellule, sont identiques à leurs équivalents bactériens[35].
S'il existe des spores chez les bactéries et les eucaryotes, elles n'ont jamais été mises en évidence dans l'ensemble des archées connues. Certaines espèces de Haloarchæa peuvent subir des modifications phénotypiques et croître avec différents types de cellules, incluant des parois épaisses. Ces structures qui sont résistantes aux chocs osmotiques permettent aux archées à survivre dans l'eau à de faibles concentrations en sel, mais ce ne sont pas des structures de reproduction et elle ne peuvent aider à la dispersion dans de nouveaux habitats[37].

Les Archæa sont particulièrement diverses, autant d'un point de vue morphologique que physiologique. Ce sont des êtres unicellulaires avec une taille variant entre 0, 1 et 15 µm, mais certains se développent pour former des filaments ou des agrégats (filaments jusqu'à 200 µm). Elles peuvent être sphériques (coques), spirales, en forme de bâtonnet, rectangulaires...
Elles font preuve d'une grande diversité de modes de reproduction, par fission binaire, bourgeonnement ou fragmentation.
Métabolisme
D'un point de vue nutritionnel, elles se répartissent en de particulièrement nombreux groupes, depuis les chimiolithoautotrophes (tirant leur énergie de gradients chimiques d'origine non biologique) aux organotrophes.
D'un point de vue physiologique, elles peuvent être aérobies, anaérobies facultatives ou strictement anaérobies.
Habitat
Les archées existent dans une large diversité d'habitats, et sont une composante importante des écodispositifs de la planète[4]. Elles peuvent contribuer jusqu'à 20% de la biomasse totale sur la Terre[38]. De nombreuses archées sont extrêmophiles, d'ailleurs, historiquement, les milieux extrêmes étaient reconnus comme leurs niches écologiques . En effet, certaines archées survivent à des températures élevées, fréquemment supérieures à 100 ° C, qu'on rencontre dans les geysers, les fumeurs noirs, et des puits de pétrole. D'autres se trouvent dans des habitats particulièrement froids et d'autres en milieu particulièrement salé, acide, ou dans l'eau alcaline. Cependant, d'autres espèces d'archées sont mésophiles et poussent dans des conditions bien plus douce, dans les marais, les eaux usées, les océans et les sols[4].
Les archées extrêmophiles sont membres des quatre principaux groupes physiologiques. Ce sont les halophiles, thermophiles, alcalophiles et acidophiles[39]. Ces groupes n'ont pas de lien avec leur embranchement dans la classification phylogénétique. Néanmoins, ils sont un point de départ utile pour la classification.
Les halophiles, comme par exemple le genre Halobacterium , vivent dans des environnements salins, tels que les lacs salés (Grand Lac Salé de l'Utah), le littoral marin, les marais salants, la Mer Morte, avec des concentrations en sel jusqu'à 25%. Les membres de l'ordre des Halobacteriales (Haloferax, Halobacterium, Halococcus, Halorubrum, Natrinema, Natronococus... ) sont des exemples d'archées halophiles. Elles ont fréquemment une pigmentation rouge à jaune à cause des caroténoïdes et sont responsables de la coloration de certains lacs (Lac Magadi au Kenya par exemple).
Les thermophiles se développent mieux à des températures supérieures à 45 ° C, dans des lieux tels que les sources d'eau chaude ; les archées hyperthermophiles sont définies comme celles qui se développent au mieux à une température supérieure à 80 ° C[40]. Pyrococcus, Methanopyrus, Thermococcus, Sulfolobus, Pyrodictium sont des exemples d'archées hyperthermophiles. Pyrobaculum provient de réservoirs profonds de pétrole chaud. Pyrolobus fumarii est capable de se multiplier jusqu'à 113 °C. Une étude récente à montré que la souche 116 de Methanopyrus kandleri pousse à 122 ° C, ce qui est la plus haute température enregistrée durant laquelle un organisme se développer[41]. D'autres archées peuvent croîtrent dans des conditions particulièrement acides ou alcalines[39]. A titre d'exemple, l'une des archées acidophiles les plus extrêmes est Picrophilus torridus , qui croît à un pH de 0, ce qui équivaut à 1, 2 molaire d'acide sulfurique[42].
Il y a peu de temps, plusieurs études ont montré que les archées existent non seulement dans les environnements mésophile et thermophile, mais sont aussi présentes, quelquefois en grand nombre, à basse température. A titre d'exemple, les archées sont communes dans les environnements froids océaniques telles que les mers polaires[43]. Les archæa sont en fait présentes en grand nombre dans tout les océans du monde dans la communauté planctonique (dans le cadre du picoplancton) [44]. Quoique ces archæa peuvent représenter jusqu'à 40% de la biomasse microbienne, presque aucune de ces espèces n'ont été isolées et étudiées en culture pure[45]. Donc, notre compréhension du rôle des archées dans l'écologie des océans est rudimentaire, de sorte que leur influence sur les cycles biogéochimiques mondiaux reste beaucoup inexploré[46]. Certaines Crenarchæota marines sont capables de nitrification, suggérant que ces organismes ont un rôle important dans le cycle de l'azote océanique[47], quoiqu'elles peuvent aussi utiliser d'autres sources énergétique[48]. La plupart d'archées sont aussi présents dans les sédiments qui recouvrent le fond de la mer, et formeraient la majorité des cellules vivantes à des profondeurs de plus de 1 mètre dans ces sédiments[49][50]. Les archéobactéries méthanogènes (productrices de méthane) des marais sont responsables des gaz des marais (Poitevin par exemple). Énormément d'Archées méthanogènes sont rencontrées dans le tube digestif des ruminants (Methanomicrobium, Methanosarcina), des termites ou des humains.
Archées et santé humaine
Jusqu'à actuellement, il n'y a pas de démonstration claire qu'il existe des archées pathogènes[51], [52], quoique des relations aient été proposées entre la présence d'archées méthanogènes et de maladies parodontales[53].
Quoiqu'la plupart d'Archæa ne soient actuellement pas cultivables en laboratoire, de nombreuses espèces peuvent être cultivées en utilisant des milieux de culture adaptés, et en reproduisant au mieux les conditions environnementales de leurs habitats naturels.
Comparaison entre archæa, bactéries et eucaryotes
Les Archæa sont identiques aux bactéries par énormément d'aspects de leur structure cellulaire et de leur métabolisme. Cependant, les mécanismes et les protéines impliquées dans les processus de réplication, de et de traduction présentent des traits identiques à ceux rencontrés chez les eucaryotes. Les particularités des Archées comparé aux deux autres domaines du vivant (Bactéries et Eucaryotes) sont les suivantes :
- la structure et la chimie des parois cellulaires, atypiques (absence de peptidoglycane classique chez les bactéries)
- la structure lipidique de leur membrane : les lipides des archéobactéries consistent en de longues chaînes d'alcool isopréniques attachées au glycérol par des liaisons éther - tandis que les autres organismes produisent les lipides de leurs membranes en assemblant deux chaînes d'acides gras avec une molécule de glycérol par l'intermédiaire d'une liaison ester
- la présence d'ARN polymérases inhabituelles, bien plus complexes que les ARN-polymérases des bactéries, et étonnamment proches de celles des eucaryotes.
- un chromosome circulaire de type bactérien mais comportant des gènes en mosaïque identiques à ceux des eucaryotes.
- les protéines intervenant dans les processus de réplication et de réparation de l'ADN ressemblent à celles rencontrées chez les eucaryotes[54].
- leur métabolisme (méthanogènes... )
Les grandes divisions chez les Archæa
Sur la base de critères seulement métaboliques, les archées ont été divisées en quatre grands groupes :
- les archéobactéries méthanogènes
- les archéobactéries halophiles
- les archéobactéries thermophiles
- les archéobactéries sulfo-dépendantes
La phylogénie, basée sur les comparaisons génétiques, essentiellement de l'ARNr 16S (un constituant des ribosomes), a permis de classer les Archæa en deux phyla :
la position de deux autres n'est pas élucidée :
Notes et références
- ↑ E. F. DeLong & N. R. Pace (2001). Environmental diversity of bacteria and archæa Syst. Biol. 50 : 470-478.
- ↑ Wœse C, Fox G (1977). Phylogenetic structure of the prokaryotic domain : the primary kingdoms. Proc Natl Acad Sci U S A 74 (11) : 5088 – 5090. [1]
- ↑ Wœse, Carl R., Kandler, Otto, Wheelis, Mark L (1990). Towards a natural system of organisms : Proposal for the domains Archæa, Bacteria, and Eucarya. Proceedings of the National Academy of Sciences 87 (12) : 4576 – 4579.
- ↑ a b c DeLong EF, «Everything in moderation : archæa as'non-extremophiles'», dans Curr. Opin. Genet. Dev. , vol. 8, no 6, 1998, p. 649–54 [texte sur PMID lien DOI]
- ↑ Theron J, Clœte TE, «Molecular techniques for determining microbial diversity and community structure in natural environments», dans Crit. Rev. Microbiol. , vol. 26, no 1, 2000, p. 37–57 [texte sur PMID lien DOI]
- ↑ Schmidt TM, «The maturing of microbial ecology», dans Int. Microbiol. , vol. 9, no 3, 2006, p. 217–23 [[pdf] texte intégral texte sur PMID]
- ↑ Gevers D, Dawyndt P, Vandamme P, et al, «Stepping stones towards a new prokaryotic taxonomy», dans Philos. Trans. R. Soc. Lond., B, Biol. Sci. , vol. 361, no 1475, 2006, p. 1911–6 [texte intégral texte sur PMID lien DOI]
- ↑ Robertson CE, Harris JK, Spear JR, Pace NR, «Phylogenetic diversity and ecology of environmental Archæa», dans Curr. Opin. Microbiol. , vol. 8, no 6, 2005, p. 638–42 [texte sur PMID]
- ↑ Huber H, Hohn MJ, Rachel R, Fuchs T, Wimmer VC, Stetter KO., «A new phylum of Archæa represented by a nanosized hyperthermophilic symbiont», dans Nature, vol. 417, no 6884, 2002, p. 27–8 [texte sur PMID lien DOI]
- ↑ Barns SM, Delwiche CF, Palmer JD, Pace NR, «Perspectives on archæal diversity, thermophily and monophyly from environmental rRNA sequences», dans Proc. Natl. Acad. Sci. U. S. A. , vol. 93, no 17, 1996, p. 9188–93 [texte intégral texte sur PMID lien DOI]
- ↑ Elkins JG, Podar M, Graham DE, et al, «A korarchæal genome reveals insights into the evolution of the Archæa», dans Proc. Natl. Acad. Sci. U. S. A. , vol. 105, no 23, juin 2008, p. 8102–7 [texte intégral texte sur PMID lien DOI]
- ↑ Baker, B. J., Tyson, G. W., Webb, R. I., Flanagan, J., Hugenholtz, P. and Banfield, J. F., «Lineages of acidophilic Archæa revealed by community genomic analysis. Science», dans Science, vol. 314, no 6884, 2006, p. 1933 – 1935 [texte sur PMID lien DOI]
- ↑ Ciccarelli FD, Dœrks T, von Mering C, Creevey CJ, Snel B, Bork P, «Toward automatic reconstruction of a highly resolved tree of life», dans Science, vol. 311, no 5765, 2006, p. 1283–7 [texte sur PMID lien DOI]
- ↑ Schopf J, «Fossil evidence of Archæan life», dans Philos Trans R Soc Lond B Biol Sci, vol. 361, no 1470, 2006, p. 869–85 [[pdf] texte intégral texte sur PMID lien DOI]
- ↑ Chappe B, Albrecht P, Michælis W, «Polar Lipids of Archæbacteria in Sediments and Petroleums», dans Science, vol. 217, no 4554, juillet 1982, p. 65–66 [texte sur PMID lien DOI]
- ↑ Brocks JJ, Logan GA, Buick R, Summons RE, «Archean molecular fossils and the early rise of eukaryotes», dans Science, vol. 285, no 5430, 1999, p. 1033–6 [texte sur PMID lien DOI]
- ↑ Rasmussen B, Fletcher IR, Brocks JJ, Kilburn MR, «Reassessing the first appearance of eukaryotes and cyanobacteria», dans Nature, vol. 455, no 7216, octobre 2008, p. 1101–4 [texte sur PMID lien DOI]
- ↑ (en) Jürgen Hahn et Pat Haug, «Traces of Archæbacteria in ancient sediments», dans System Applied Microbiology, vol. 7, no Archæbacteria'85 Proceedings, 1986, p. 178–83.
- ↑ Wœse CR, Gupta R, «Are archæbacteria merely derived'prokaryotes'?», dans Nature, vol. 289, no 5793, 1981, p. 95–6 [texte sur PMID lien DOI]
- ↑ Wœse C, «The universal ancestor», dans Proc. Natl. Acad. Sci. U. S. A. , vol. 95, no 12, 1998, p. 6854–9 [texte intégral texte sur PMID lien DOI]
- ↑ Gupta RS, «The natural evolutionary relationships among prokaryotes», dans Crit. Rev. Microbiol. , vol. 26, no 2, 2000, p. 111–31 [texte sur PMID lien DOI]
- ↑ Di Giulio, M. (2003) The universal ancestor was a thermophile or a hyperthermophile : tests and further evidence. J Theor Biol 221 : 425-436. ]
- ↑ Forterre, P., de la Tour, C. B., Philippe, H., and Duguet, M. (2000) Reverse gyrase from hyperthermophiles - probable transfer of a thermoadaptation trait from Archæa to Bacteria. Trends in Genetics 16 : 152-154.
- ↑ Gribaldo S, Brochier-Armanet C, «The origin and evolution of Archæa : a state of the art», dans Philos. Trans. R. Soc. Lond., B, Biol. Sci. , vol. 361, no 1470, 2006, p. 1007–22 [texte intégral texte sur PMID lien DOI]
- ↑ Wœse CR, «There must be a prokaryote somewhere : microbiology's search for itself», dans Microbiol. Rev. , vol. 58, no 1, mars 1994, p. 1–9 [texte intégral texte sur PMID]
- ↑ Lake JA, «Origin of the eukaryotic nucleus determined by rate-invariant analysis of rRNA sequences», dans Nature, vol. 331, no 6152, janvier 1988, p. 184–6 [texte sur PMID lien DOI]
- ↑ Gouy M, Li WH, «Phylogenetic analysis based on rRNA sequences supports the archæbacterial rather than the eocyte tree», dans Nature, vol. 339, no 6220, mai 1989, p. 145–7 [texte sur PMID lien DOI]
- ↑ Yutin N, Makarova KS, Mekhedov SL, Wolf YI, Koonin EV, «The deep archæal roots of eukaryotes», dans Mol. Biol. Evol. , vol. 25, mai 2008, p. 1619 [texte intégral texte sur PMID lien DOI]
- ↑ Nelson KE, Clayton RA, Gill SR, et al, «Evidence for lateral gene transfer between Archæa and bacteria from genome sequence of Thermotoga maritima», dans Nature, vol. 399, no 6734, 1999, p. 323–9 [texte sur PMID lien DOI]
- ↑ Lake JA., «Origin of the eukaryotic nucleus determined by rate-invariant analysis of rRNA sequences», dans Nature, vol. 331, no 6152, 1988, p. 184–6 [texte sur PMID lien DOI]
- ↑ Galagan JE, et al, «The genome of M. acetivorans reveals extensive metabolic and physiological diversity», dans Genome Research, vol. 12, no 4, 2002-04, p. 532–42 [texte intégral lien DOI]
- ↑ Waters E, et al, «The genome of Nanoarchæum equitans : insights into early archæal evolution and derived parasitism», dans Proc. Natl. Acad. Sci. U. S. A. , vol. 100, no 22, 2003, p. 12984–8 [texte intégral texte sur PMID lien DOI]
- ↑ Schleper C, Holz I, Janekovic D, Murphy J, Zillig W, «A multicopy plasmid of the extremely thermophilic archæon Sulfolobus effects its transfer to recipients by mating», dans J. Bacteriol. , vol. 177, no 15, 1995, p. 4417–26 [texte intégral texte sur PMID]
- ↑ Sota M; Top EM (2008). "Horizontal Gene Transfer Mediated by Plasmids", {{{title}}}. Caister Academic Press. ISBN 978-1-904455-35-6.
- ↑ a b Bernander R, «Archæa and the cell cycle», dans Mol. Microbiol. , vol. 29, no 4, 1998, p. 955–61 [texte sur PMID lien DOI]
- ↑ Kelman LM, Kelman Z, «Multiple origins of replication in archæa», dans Trends Microbiol. , vol. 12, no 9, 2004, p. 399–401 [texte sur PMID lien DOI]
- ↑ Kostrikina NA, Zvyagintseva IS, Duda VI., «Cytological peculiarities of some extremely halophilic soil archæobacteria», dans Arch. Microbiol. , vol. 156, no 5, 1991, p. 344–49 [lien DOI]
- ↑ DeLong EF, Pace NR, «Environmental diversity of bacteria and archæa», dans Syst. Biol. , vol. 50, no 4, 2001, p. 470–8 [texte sur PMID lien DOI]
- ↑ a b Pikuta EV, Hoover RB, Tang J, «Microbial extremophiles at the limits of life», dans Crit. Rev. Microbiol. , vol. 33, no 3, 2007, p. 183–209 [texte sur PMID lien DOI]
- ↑ Madigan MT, Martino JM (2006). {{{title}}}, 11th ed., Pearson, 136. ISBN 0-13-196893-9.
- ↑ Takai K, Nakamura K, Toki T, Tsunogai U, Miyazaki M, Miyazaki J, Hirayama H, Nakagawa S, Nunoura T, Horikoshi K, «Cell proliferation at 122°C and isotopically heavy CH4 production by a hyperthermophilic methanogen under high-pressure cultivation», dans Proc Natl Acad Sci U S A, vol. 105, 2008, p. 10949–54 [lien DOI]
- ↑ Ciaramella M, Napoli A, Rossi M, «Another extreme genome : how to live at pH 0», dans Trends Microbiol. , vol. 13, no 2, février 2005, p. 49–51 [texte sur PMID lien DOI]
- ↑ López-García P, López-López A, Moreira D, Rodríguez-Valera F, «Diversity of free-living prokaryotes from a deep-sea site at the Antarctic Polar Front», dans FEMS Microbiol. Ecol. , vol. 36, no 2–3, juillet 2001, p. 193–202 [texte sur PMID]
- ↑ Karner MB, DeLong EF, Karl DM, «Archæal dominance in the mesopelagic zone of the Pacific Ocean», dans Nature, vol. 409, no 6819, 2001, p. 507–10 [texte sur PMID lien DOI]
- ↑ Giovannoni SJ, Stingl U., «Molecular diversity and ecology of microbial plankton», dans Nature, vol. 427, no 7057, 2005, p. 343–8 [texte sur PMID lien DOI]
- ↑ DeLong EF, Karl DM, «Genomic perspectives in microbial oceanography», dans Nature, vol. 437, no 7057, septembre 2005, p. 336–42 [texte sur PMID lien DOI]
- ↑ Konneke M, Bernhard Æ, de la Torre JR, Walker CB, Waterbury JB, Stahl DA., «Isolation of an autotrophic ammonia-oxidizing marine archæon», dans Nature, vol. 437, no 7057, 2005, p. 543–6 [texte sur PMID lien DOI]
- ↑ Agogué H, Maaike B, Dinasquet J, Herndl GJ., «Major gradients in putatively nitrifying and non-nitrifying Archæa in the deep North Atlantic», dans Nature, vol. 456, no 7223, 2008, p. 788-791 [lien DOI]
- ↑ Teske A, Sørensen KB, «Uncultured archæa in deep marine subsurface sediments : have we caught them all?», dans ISME J, vol. 2, no 1, janvier 2008, p. 3–18 [texte sur PMID lien DOI]
- ↑ Lipp JS, Morono Y, Inagaki F, Hinrichs KU, «Significant contribution of Archæa to extant biomass in marine subsurface sediments», dans Nature, juillet 2008 [texte sur PMID lien DOI]
- ↑ Eckburg P, Lepp P, Relman D (2003). "Archæa and their potential role in human disease". Infect Immun 71 (2) : 591-6.
- ↑ Cavicchioli R, Curmi P, Saunders N, Thomas T (2003). "Pathogenic archæa : do they exist?". Biœssays 25 (11) : 1119-28.
- ↑ Lepp P, Brinig M, Ouverney C, Palm K, Armitage G, Relman D (2004). "Methanogenic Archæa and human periodontal disease". Proc Natl Acad Sci U S A 101 (16) : 6176-81.
- ↑ Kelman, Z. (2000) DNA replication in the third domain (of life). Curr Protein Pept Sci 1 : 139-154.
Voir aussi
- Bactéries carrées de Walsby
- Règnes du vivant
- Archæa (classification phylogénétique)
- Eubactéries
- Phylogénie
- Extrémophile
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 17/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité