Thymine DNA glycosylase
La thymine DNA glycosylase ou G/T mismatch-specific thymine DNA glycosylse est une enzyme. Chez l'homme c'est une protéine monomérique de 410 acides aminés codés par 1233 paires de bases sur le chromosome 12 locus 24.
Recherche sur Google Images :

Source image : www.scivee.tv Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- During DNA mismatch repair, SUMO conjugation of the uracil/ thymine DNA glycosylase TDG promotes the release of TDG from the abasic (AP) site created after... (source : lib.bioinfo)
- This approach yielded potent inhibitors of the mammalian 3-methyladenine glycosylase ANPG and the mismatch-specific thymine DNA glycosylase TDG (12, 13).... (source : wipo)
La thymine DNA glycosylase ou G/T mismatch-specific thymine DNA glycosylse (TDG) est une enzyme. Chez l'homme c'est une protéine monomérique de 410 acides aminés codés par 1233 paires de bases sur le chromosome 12 locus 24.1. [1]. C'est une protéine qui agit à plusieurs niveaux de régulation mais qui n'a qu'une fonction catalytique : la réparation de l'ADN.
Utilisation
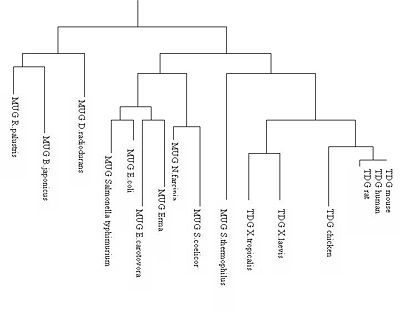
Depuis les découvertes des glycosylases d'ADN dans les années 1975, les variations de la thymine DNA glycosylase est utilisée pour déterminer la parenté dans l'arbre phylogénétique des vertébrés car une certaine homologie est gardée à travers le temps et les différentes espèces. Ceci est caractérisé par la conservation du site catalytique de la TDG. L'uracile DNA glycosylase (MUG) joue le même rôle dans les autres embranchements. Il semblerait par exemple que la MUG Escherichia coli possède 37% d'homologie avec la TDG humaine[2].
Les substrats de la TDG
La Thymine DNA glycosylase ne peut enlever un couple de bases A/T par exemple, dans la mesure où il n'est pas un mésappariements[3]. Qui plus est , la TDG est incapable de réparer un simple brin d'ADN, uniquement l'ADN double brin. Elle reconnaît et signale préférentiellement les thymines et uraciles des mésappariements T/G et U/G, fréquemment créés par des désaminations spontanées de la cytosine ou de la 5-méthylcytosine [4]. La TDG est aussi en mesure d'exciser l'uracile et le 5-bromouracile. Qui plus est , certains traitements contre le cancer sont inefficaces compte tenu de l'habileté de la TDG à substituer le 5-fluorouracile. Il semblerait que cette glycosylase ait la capacité de réparer les bases endommagées liées avec des thymines et des cytosines, mais cette hypothèse est plutôt controversé[5].
Les principes de réparation de l'ADN
Au cours de sa vie, une cellule, peu importe sa provenance, est confrontée à des évènements susceptibles de créer des erreurs de réplication ou encore des mutations dans son ADN. Ces erreurs sont envisageablement créées par la désamination, l'oxydation ou l'alkylation des bases azotées. Qui plus est , les rayons X ou les UV ont la capacité d'endommager l'ADN. De nombreuses méthodes sont utilisées par la cellule pour réparer son ADN et celle utilisée, mais aussi les enzymes impliqués dépendent entre autre de l'importance de la mutation. En effet, ces dernières ne créent pas un même degré de distorsion de la double hélice quand elles se produisent. Un simple mésappariement d'une base azotée ne produit pas une distorsion de l'ADN suffisante pour être reconnue par l'ensemble des enzymes de réparation. Par contre, la thymine DNA glycosylase est en mesure de détecter cette erreur et de la réparer.
On dit de la TDG qu'elle est une glycosylase monofonctionnelle c'est-à-dire qu'elle hydrolyse le lien N-glycosydique entre le squelette de désoxyribose phosphate et la base endommagée pour créer un site abasique ou «site AP». Elle est incapable de couper le squelette lui-même, d'autres enzymes auront cette tâche.
Pour contrer certains mésappariements de l'ADN, la TDG utilise la voie du «Base excision repair» (BER), au contraire de d'autres enzymes de réparation qui peuvent utiliser la voie du «Nucleotid excision repair» (NER). La TDG est en mesure d'exciser une base azotée endommagée en suivant le principe du «short patch repair» une des voies du BER.
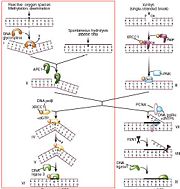
Réparation de l'ADN par le principe d'excision d'une base endommagée[6], "short patch repair".
|
Premièrement, quand il y a une base azotée endommagée dans un brin double d'ADN, la Thymine DNA glycosylase la reconnaît et signale l'emplacement de la mutation. La TDG hydrolyse le lien N-glycosidique par lequel la base est attachée au squelette de sucre et la mutation est retirée, le site AP est créé. Quand la TDG dégage la base endommagée, une forte affinité s'installe entre l'enzyme et la guanine restante en face du site AP. L'endonucléase APE-1, en s'approchant de la TDG, permettra de diminuer cette affinité pour déloger la TDG du site AP. L'APE-1 pourra ensuite effectuer le clivage du nucléotide abasique. La Pol β viendra ensuite polymériser le nouveau nucléotide et la ligase 3 terminera la réparation. |
Xeroderma pigmentosum
La Xeroderma pigmentosum (XP) est maladie autosomique récessive rare, qui se définit par une sensibilité accrue aux rayons U. V. du soleil chez les patients homozygotes pour la mutation et même chez les hétérozygotes. Certaines personnes seront atteintes par une dégénérescence du dispositif nerveux, à peu près 20%, et énormément seront atteints par les troubles ophtalmologiques. Quoi qu'il en soit, la grande majorité seront touchés par des carcinomes de la peau et des mélanomes. [7] Une personne sur 500 aurait un allèle du gène muté.
La protéine en cause dans cette affectation est la XPC, une enzyme de réparation de l'ADN impliquée dans le NER. Des études [8] tendent à prouver que la XPC, complexé avec la HR23B, joue aussi un rôle dans la voie du BER. En effet, le complexe XPC-HR23B tiendrait un rôle comparable à la APE-1 pour libérer la TDG du site AP, site pour lequel elle a trop d'affinités.
Les mutations observées [9] sur le gène XPC sont créées par des non-sens, des décalages du cadre de lecture ou encore des anomalies dans le processus d'épissage. Qui plus est , il semble qu'environ 8 gènes soient impliqués dans la Xeroderma pigmentosum. A titre d'exemple, des mutations sur des oncogènes tel que RAS et des gènes suppresseurs de tumeurs tel que p53 ont été découvertes dans des fibroblastes XP. [7]
Il parait évident que si la XCP-HR23B n'est plus en mesure d'exercer son influence sur la TDG, cette dernière s'accrochera à la guanine du site AP plus longtemps, altérant son efficacité de réparation. Les mutations de l'ADN n'étant plus excisées, la cellule devra utiliser les voies de signalisation bloquant le cycle cellulaire pour ne pas se diviser en présence d'ADN erroné. Par contre, si ces voies, incluant p53, sont elles aussi touchées par des mutations dans leur propre ADN, la cellule ne possède plus les mécanismes nécessaires pour se diviser normalement et elle risque de devenir une cellule transformée, formant un cancer.
- ↑ [réf. souhaitée]http ://www. pubmed. com
- ↑ Hardeland, U., Bentele, M., Jiricny, J., Schär, P., 2003. The versatile thymine DNA glycosylase : a comparative characterisation of the human, Drosophila and fission yeast orthologs. Nucleic Acids Research, Vol. 31, No. 9, p. 2261-2271.
- ↑ Yoon, J-H., Iwai, S., O'Connor, T. R., Pfeifer, G. P., 2003. Human thymine DNA glycosylase and methyl-CpG-binding protein 4 (MBD4) excise thymine glycol (Tg) from a Tg :G mispair. Nucleic Acids Research, Vol. 31, No. 18, p. 5399-5404.
- ↑ Abu, M., Waters, T. R., 2003, The main role of human Thymine DNA glycosylase is removal of thymine produced by desaminaion of 5-methylcytosine and not removal of ethenocytosine. The journal of biological chemistry. Vol. 278, No. 10, p. 8739-8744.
- ↑ Mohan, R. D., Rao, A., Gagliardi, J. and Tini, M., 2007, SUMO-1-dependent allosteric regulation of thymine DNA glycosylase alters subnuclear localization and CBP/p300 recruitment. Mol. Cell. Biol. Vol. 27, p. 229-243.
- ↑ http ://idg. u-strasbg. fr/PDFcours/cours_VS_2006. pdf
- ↑ a b point_scientifique
- ↑ Shimizu, Y., Iwai, S., Hanaoka, F., Sugasawa, K. 2003, Xeroderma pigmentosum group C protein interact physically and functionally eith thymine DNA glycosylase. The EMBO journal, Vol. 22, No. 1, p. 164-173.
- ↑ Reduced XPC DNA repair gene mRNA levels in clinically normal parents of xeroderma pigmentosum patients - Khan et al. 27 (1) : 84 - Carcinogenesis
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 17/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité