Réaction en chaîne par polymérase
La réaction en chaîne par polymérase, est une méthode de biologie moléculaire d'augmentcation génique in vitro, qui sert à copier en grand nombre, une séquence d'ADN ou d'ARN connue, à partir d'une faible quantité d'acide nucléique ou amorces...
Recherche sur Google Images :
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ... La réaction PCR (Polymerase Chain Reaction) permet d'augmenter... A la fin de chaque cycle, les produits sont sous forme d'ADN double brin.... (source : books.google)
- La réaction en chaîne par polymérase (PCR en anglais pour Polymerase..... La courbe représente par conséquent la cinétique d'augmentcation de l'ADN cycle par cycle.... (source : dictionary.sensagent)
La réaction en chaîne par polymérase (PCR est l'abréviation anglophone de Polymerase Chain Reaction, l'acronyme français ACP pour Augmentcation en Chaîne par Polymérisation est particulièrement rarement utilisée), est une méthode de biologie moléculaire d'augmentcation génique in vitro, qui sert à copier en grand nombre (avec un facteur de multiplication de l'ordre du milliard), une séquence d'ADN ou d'ARN connue, à partir d'une faible quantité (de l'ordre de quelques picogrammes) d'acide nucléique (séquence spécifique d'ADN (l'Amplicon) ou amorces spécifiques constituées d'oligonucléotides de synthèse de 20 à 25 nucléotides). Cette technique permet entre autres de détecter la présence du virus VIH ou de mesurer la charge virale (concentration du virus dans le plasma), des OGM (organismes génétiquement modifiés), des virus des hépatites B, C et D. De plus en plus utilisée en criminalistique, cette technique est basée sur la combinaison de deux facteurs :
- Les propriétés de synthèse enzymatique et d'initiation «ADN double brins spécifique» des «ADN polymérases ADN dépendantes thermostables».
- Les propriétés d'hybridation et de deshybridation des brins complémentaires d'ADN selon la température.
Ces éléments permettent de contrôler l'activité enzymatique grâce à des transitions de température (assurées par un thermocycleur) répétées de manière cyclique (cf. réaction en chaîne).
Les premières ADN polymérases utilisées provenaient d'une bactérie thermophile (résistante à des températures particulièrement élevées), par exemple Thermus aquaticus (Taq polymérase) ou encore Pyrococcus furiosus (Pfu polymérase), Thermococcus litoralis (Vent ou Tli polymérase), Thermus thermophilus (Tth polymérase). Actuellement, les enzymes utilisées sont dites recombinantes, ce qui simplifie énormément leur obtention, et leurs propriétés ont été beaucoup modifiées pour les rendre plus efficaces, plus fidèles…
En moins de dix ans, cette technique (maintenant capable de faire plus d'un milliard de copies en moins d'une heure) s'est vu consacrée dans les laboratoires et a révolutionné la biologie moléculaire.
Historique
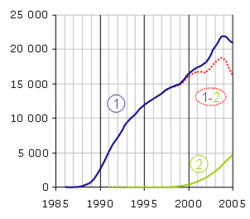
La PCR est une technologie qui a bouleversé la biologie moléculaire et s'est implantée particulièrement rapidement dans les laboratoires. Par contre, la PCR en temps réel a dû attendre la mise sur le marché d'un certain nombre d'innovations technologiques avant de se développer et est toujours reconnue comme une méthodologie nouvelle. Le nombre d'articles par année répondant aux mots clés (1) "polymerase chain reaction" et (2) "real-time polymerase chain reaction" sur le moteur de recherche PubMed donne une assez bonne idée de leur importance dans le monde scientifique. Notez que la méthode n'est pas exempte de biais, par exemple quelques articles sont trouvés pour la PCR en temps réel en 1991 et 1992 (en pointillé) tandis que son principe n'a été décrit qu'en 1993. La différence (1-2) est représentative du poids de la PCR en point final, qui va certainement céder progressivement la place au temps réel.
Cette technique a beaucoup évolué depuis ses débuts. Parmi les évolutions les plus principales, on retrouve :
- Le remplacement des fragments de Klenow d'ADN polymérase I d'E. coli par une polymérase thermorésistante (originellement la Taq) qui évite de devoir remettre de l'enzyme à chaque cycle. Cette innovation permet un bond énorme vers l'automatisation et évite de devoir ouvrir le tube réactionnel, limitant énormément le risque de contamination.
- La généralisation des thermocycleurs (un bon nombre d'anciennes expérimentations ont été réalisées avec trois bains-marie) a permis de rendre la PCR moins contraignante, plus reproductible et était un pré requis indispensable à la majorité des applications nouvelles.
- L'invention de la PCR en temps réel qui sert à rendre la méthode quantitative et évite plusieurs étapes expérimentales contraignantes, telles l'électrophorèse sur gel d'agarose, l'acquisition de fluorescence, la calibration de l'acquisition du signal, etc.
Par souci de clarté, les dates correspondent à la première publication sur le domaine et seuls les premiers auteurs sont cités, les références complètes étant dans le chapitre "bibliographie". Ce choix permet en outre de limiter les polémiques telles le rôle de Rosalind Elsie Franklin dans la découverte de la structure de la double hélice d'ADN.
- 1953 : Découverte de la structure en double hélice de l'ADN par James Dewey Watson et Francis Harry Compton Crick, (prix Nobel de physiologie ou médecine en 1962).
- 1956 : Découverte de l'ADN polymérase ADN dépendante (ADN pol I) par Arthur Kornberg (prix Nobel de physiologie ou médecine en 1959).
- 1970 : Co-découverte indépendante de l'ADN polymérase ARN dépendante par Temin HM et Baltimore D (prix Nobel de physiologie ou médecine en 1975).
- 1986 : Première publication publique sur la PCR par Kary Mullis (prix Nobel de chimie en 1993).
- 1988 : Première PCR réalisée avec une ADN polymérase thermostable, provenant de Thermus aquaticus, par Saiki RK.
- 1991 : Première détection du produit de PCR par sonde (sonde d'hydrolyse) par Holland PM.
- 1992 : Invention de la PCR en temps réel par Higuchi R.
- 1995 : Première publication sur la TAIL-PCR par Liu YG
- 1996 : Mise au point des polymérases provisoirement inactives et activables par la chaleur par Birch DE.
- 1997 : Mise en évidence de la variation de température "Tm dépendante" du SYBR green par Wittwer CT.
- 1997 : Première discrimination d'allèle grâce à la courbe de fusion par Lay MJ.
Principe
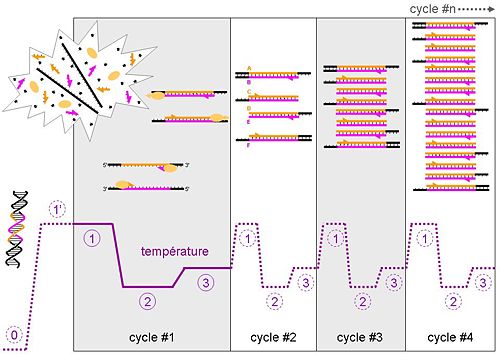
La PCR est une technique basée sur une répétition de cycles de transition de température. Sauf pour certaines méthodologies (par exemple l'utilisation de sondes d'hydrolyse), chaque cycle contient trois étapes détaillées ci-dessous. Par souci de didactisme, nous allons considérer pour l'exemple qui suit une efficacité de PCR de 100%.
Cette étape se fait le plus souvent à température ambiante. L'ADN bicaténaire adopte sa conformation en double hélice. Dans cet exemple, nous considérerons qu'il n'y a qu'une molécule d'origine d'ADN double brin dans la solution, la zone colorée (rose et orange) correspondant à notre amplicon. Note : les ADN complémentaires issus de la transcription inverse sont le plus souvent simple brin et adopteront alors de complexes conformations tridimensionnelles identiques à celle des ARN.
Dénaturation d'origine (1'sur le schéma)
Avant de commencer les cycles de PCR lui-même, une étape de chauffage (généralement 10 à 15 minutes à 95°C) est réalisée. Cette étape permet de : déshybrider les ADN double brin, de casser les structures secondaires, d'homogénéiser le milieu réactionnel par agitation thermique, d'activer les polymérases de type «Hot start», de dénaturer d'autres enzymes qui pourraient être dans la solution (Transcriptase Inverse, Uracil-N-Glycosylase).
Phase de dénaturation (1 sur le schéma)
Cette étape (généralement 0 à 1 minute à 95°C) sert à déshybrider les ADN, de «décrocher» les polymérases qui seraient toujours liées à une matrice et d'homogénéiser le milieu réactionnel.
Phase d'hybridation ou d'appariement des amorces (2 sur le schéma)
Cette étape (généralement 2 à 60 secondes à 56-64°C) permet aux amorces sens et anti-sens de s'hybrider aux ADN matrice grâce à une température qui leur est thermodynamiquement favorable. Peu de brins d'ADN matrice peuvent s'hybrider (se lier) avec leur brin complémentaire, ce qui empêcherait la fixation des amorces, car ces dernières sont énormément plus courtes et en concentration énormément plus importante. Expérimentalement, il est constaté que la PCR fonctionne même avec une phase d'hybridation avec une température supérieure de quelques degrés au Tm théorique des amorces, certainement parce qu'elles interagissent déjà avec les polymérases, qui stabiliseraient leur hybridation à l'ADN matrice.
Phase d'élongation (3 sur le schéma)
Cette étape (généralement 4 à 120 secondes à 72°C) permet aux polymérases de synthétiser le brin complémentaire de leur ADN matrice à une température qui leur est optimale. Ce brin est fabriqué à partir des dNTPs libres présents dans le milieu réactionnel. La durée de cette étape dépend normalement de la longueur de l'amplicon.
-
- Lors de la phase 1, nous constatons que l'ADN d'origine a adopté une conformation «linéaire» (sans structure secondaire) et simple brin. Les amorces, les dNTPs et les polymérases sont en large excès et répartis de façon homogène dans la solution.
- Lors de la phase 2, une des amorces sens s'hybride avec sa séquence complémentaire sur le brin anti-sens (en rose), une des amorces anti-sens se liant elle au brin sens (en orange). Deux polymérases peuvent alors interagir avec les deux complexes amorces/ADN matrice.
- Lors de la phase 3, les polymérases parcourent leur brin matrice de son extrémité 3' vers son extrémité 5' tout en synthétisant le brin complémentaire. Elles s'arrêteront à la fin du cycle, décrochées par la phase de dénaturation du cycle suivant. Les ADN néo-synthétisés sont par conséquent exactement définis à leur extrémité 5'mais pas à leur extrémités 3' (parties noires). Les ADN sont alors bicaténaires sur une longueur plus ou moindre.
- A la fin de l'étape 3, nous avons alors deux brins d'ADN matrice et deux brins (un sens et un anti-sens) d'ADN exactement définis à leur extrémité 5'seulement.
Cycle n°2
Les trois phases se déroulent de la même manière qu'au cycle n°1, sauf que deux polymérases arrivées au bout de leur ADN matrice se décrochent spontanément. À la fin de la phase 3, nous obtenons l'ensemble des types d'ADN qui existeront lors de la PCR, soit :
-
- Un brin d'ADN natif sens (A).
- Deux brins d'ADN sens exactement définis à leur extrémité 5'seulement (B).
- Un brin d'ADN anti-sens correspondant à l'amplicon, c'est-à-dire exactement défini à ses deux extrémités (C).
- Deux brins d'ADN anti-sens exactement définis à leur extrémité 5'seulement (D).
- Un brin d'ADN sens correspondant à l'amplicon, c'est-à-dire exactement défini à ses deux extrémités (E).
- Un brin d'ADN natif anti-sens (F).
Cycle n°3
Idem au cycle 2. À la fin de la phase 3, nous observons 1 brin de type A et F, 3 de B et D, et 4 de C et E. Nous observons la naissance de deux molécules d'ADN double brins C-E qui correspond à notre amplicon.
Cycle n°4
Idem au cycle 3. À la fin de la phase 4, nous observons 1 brin de type A et F, 4 de B et D, et 11 de C et E. Nous observons que l'amplicon devient la combinaison majoritaire.
Cycles au delà de 4
Si nous avions augmenté le nombre de cycles, nous aurions obtenu le tableau suivant :
| cycle numéro : | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | n | ||
| type de molécule | A | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | = An − 1 + 0 |
| B | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | = Bn − 1 + 1 | |
| C | 0 | 0 | 1 | 4 | 11 | 26 | 57 | 120 | 247 | 502 | 1013 | 2036 | 4083 | 8178 | 16369 | 32752 | = Cn − 1 + (Bn − 1 + En − 1) | |
| D | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | = Dn − 1 + 1 | |
| E | 0 | 0 | 1 | 4 | 11 | 26 | 57 | 120 | 247 | 502 | 1013 | 2036 | 4083 | 8178 | 16369 | 32752 | = En − 1 + (Cn − 1 + Dn − 1) | |
| F | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | = Fn − 1 + 0 | |
| simple brin | nombre | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | 512 | 1024 | 2048 | 4096 | 8192 | 16384 | 32768 | 65536 | = Σ An à Fn |
| % amplicon | 0, 00 | 0, 00 | 25, 00 | 50, 00 | 68, 75 | 81, 25 | 89, 06 | 93, 75 | 96, 48 | 98, 05 | 98, 93 | 99, 41 | 99, 68 | 99, 83 | 99, 91 | 99, 95 | = 100 * (Cn + En) / Σsimplebrin | |
| double brins | nombre | 1 | 2 | 4 | 8 | 16 | 32 | 64 | 128 | 256 | 512 | 1024 | 2048 | 4096 | 8192 | 16384 | 32768 | = Σsimplebrin / 2 |
| % amplicon | 0, 00 | 0, 00 | 0, 00 | 12, 50 | 43, 75 | 65, 63 | 79, 69 | 88, 28 | 93, 36 | 96, 29 | 97, 95 | 98, 88 | 99, 39 | 99, 67 | 99, 82 | 99, 91 | = 100 * ( (Cn − Bn) + (En − Dn) ) / Σdoublebrin | |
En analysant ce tableau, nous constatons que :
- Les molécules d'ADN natif (A et F) ne sont pas dupliquées.
- Les molécules exactement définies à leur extrémité 5'seulement (B et D) augmentent de manière linéaire (de 1 par cycle sauf si l'ADN natif se dégrade).
- Le nombre de molécules simple ou double brin augmente selon une exponentielle d'ordre 2.
- Les molécules contenant la séquence exacte à augmenter (C et E) apparaissent dès le deuxième cycle et augmentent selon une suite arithmétique qui tend vers une exponentielle d'ordre 2 quand le nombre de cycles augmente. Notez que dès le dixième cycle, elles représentent près de 99% de la totalité.
- L'amplicon (les couples C-E) apparaît dès le troisième cycle et augmente selon une loi de même type que ses composants. Il représente près de 98 % des molécules au dixième cycle, 99, 91 % au quinzième (zone où les ADNc issus d'ARNm fortement exprimés débutent le plus souvent à devenir détectables) .
Ces valeurs ont été obtenues en partant d'une seule molécule d'origine d'ADN double brins, mais autrement, chaque matrice aurait subi le même processus. À un cycle donné, la quantité d'ADN dépend par conséquent du nombre d'origine de matrices. Par contre, quelle que soit sa concentration d'origine, il est théoriquement envisageable d'obtenir n'importe quelle quantité en ajustant le nombre de cycles. La PCR est par conséquent régie théoriquement par la loi :
[ADN]cyclen = [ADN]initialexEn
Mais la PCR est une réaction enzymatique complexe. Le produit est semblable au substrat et peut venir inhiber l'enzyme, mais en particulier, les réactifs secondaires (amorces, dNTP) peuvent commencer à manquer. La PCR ne peut par conséquent avoir une loi d'augmentcation exponentielle que tant que l'ADN matrice est l'unique facteur limitant. La réaction devient ensuite imprédictible et il est alors impossible de pouvoir comparer plusieurs échantillons entre eux sans un biais quantitatif plus ou moins significatif (voir l'article sur la PCR quantitative). Il est par conséquent important de bien comprendre les différentes phases d'une cinétique de PCR.
Cinétique mesurable d'une PCR
Ce chapitre traite des cinétiques mesurables d'une PCR, car des limitations technologiques rendent inaccessibles les cycles précoces, et le plus souvent une large portion de la partie exponentielle. Son profil apparent (mesurable) adopte plusieurs phases différentes, plus ou moins développées selon choix méthodologiques.
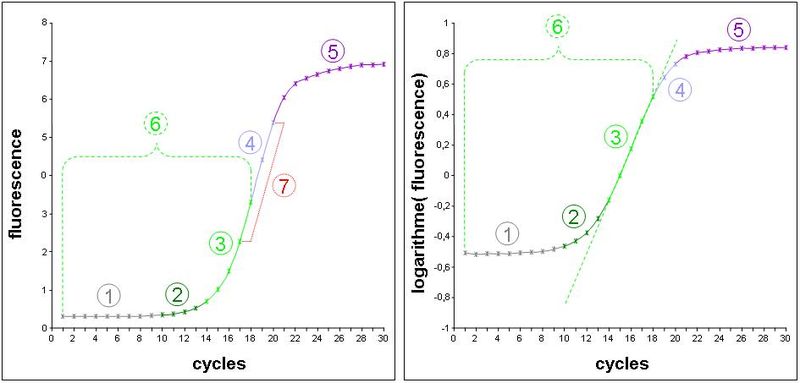
- Schéma de gauche : données expérimentales d'une cinétique de PCR mesurée sur un thermocycleur en temps réel. La fluorescence émise par un intercalant de l'ADN est proportionnelle à la quantité d'ADN présent (cad surtout l'amplicon). La courbe représente par conséquent la cinétique d'augmentcation de l'ADN cycle par cycle.
- Schéma de droite : les valeurs de fluorescence précédentes ont été converties en logarithme décimal. Une cinétique de type exponentiel devrait par conséquent être transformée en un segment de droite (segment quantifiable).
- 1) Bruit de fond de la fluorescence aspécifique du marqueur. Son niveau est particulièrement dépendant de la nature du marqueur et du soluté de l'échantillon.
- 2) Zone où la mesure de fluorescence est biaisée par le bruit de fond. Elle se distingue facilement sur le schéma de droite car elle adopte un profil d'exponentielle, tandis que les valeurs sont déjà dans un repère semi-logarithmique.
- 3) Zone de la cinétique en phase exponentielle et mesurable sans biais. Elle adopte dans le schéma de gauche l'apparence d'un segment de droite appelé segment quantifiable. Remarquez que dans cet exemple expérimental, il ne fait que 5 cycles.
- 4) Zone de la cinétique où la polymérase devient un facteur limitant. L'accumulation d'amplicon se fait alors de manière constante et devient linéaire sur le schéma de gauche.
- 5) Phases d'amortissement puis de plateau de la cinétique dues à la naissance de facteurs limitants non constants (dNTP, fluorophore, etc. ), de dégradation de l'activité enzymatique, de la qualité de fluorescence…
- 6) Phase de la cinétique qui répondait réellement à une loi exponentielle, mais seule la zone 3 est réellement exploitable (sauf pour le maxima de dérivé seconde en PCR en temps réel).
- 7) Zone linéaire sur le schéma de gauche. Une erreur classique en PCR en point final était de déterminer cette zone grâce à une gamme de cycles pour tenter de faire une mesure quantitative de l'ADNc d'origine à ce niveau.
Efficacité de la PCR
L'avènement de la PCR en temps réel a mis en exergue que l'efficacité d'une réaction de PCR (généralement notée E) n'était pas forcément identique à deux. Cela veut dire que sur la totalité des cycles reconnus comme quantitatif (zone n° 6 de la cinétique), l'ensemble des brins matrices ne servent pas nécessairement à donner une copie complète de l'amplicon. Deux phénomènes en sont les principales causes :
- Tous les brins matrices ne sont pas nécessairement liés par un complexe amorce/polymérase lors de la phase d'hybridation. La probabilité d'amorçage peut être influencée par la température, la longueur et la séquence de l'amorce, sa composition en nucléotides naturels ou modifiés, sa concentration dans la solution, la composition ionique de cette dernière, l'auto-hybridation entre les amorces ou la compétition envisageable d'ADN non cible (par exemple un pseudo-gène).
- Toutes les synthèses ne sont pas nécessairement complètes, surtout si la phase d'élongation est trop courte. Un brin incomplet à son extrémité 3'ne peut pas servir de matrice car l'amorce complémentaire ne peut pas se lier à lui.
Cette efficacité est par conséquent théoriquement inférieure ou identique à deux mais certaines sources considèrent qu'elle est acceptable jusqu'à 2, 3!
Ce qui suit peut être un élément de controverse !
L'auteur de ce chapitre n'a pour le moment trouvé aucune source justifiant cette position. Il considère qu'il y a deux types d'explication envisageable :
- Une part significative (jusqu'à 30%) des brins d'ADN servent plusieurs fois de matrice pendant un cycle et cette proportion est conservée pendant toute la phase exponentielle. Par conséquent pour chacune de ces matrices, un complexe amorce/polymérase s'est fixé une première fois, une synthèse complète a été effectuée, l'ADN double brin s'est déshybridé à une température extrêmement défavorable, un second complexe amorce/polymérase s'est fixé à une température certainement défavorable (étape d'élongation) et qu'une seconde synthèse complète a eu lieu.
- Un biais expérimental (dans un facteur de dilution par exemple) ou d'analyse mathématique (généralement commis par l'utilisation inappropriée d'outil d'optimisation présent dans le logiciel du thermocycleur) a été commis. Ces deux types de biais ont été plusieurs fois constatés.
La majorité des protocoles expérimentaux donne une efficacité de PCR entre 1, 75 et 2. Deux écoles s'affrontent alors, avec des arguments expérimentaux à l'appui. L'une considère que cette efficacité est une constante pour chaque amplicon dans un protocole expérimental donné. L'autre estime qu'elle fluctue toujours significativement et qu'elle nécessite d'être constamment remesurée. Il convient de noter qu'il est particulièrement complexe de savoir si une variation d'une efficacité de PCR observée vient de la nature même de cette méthode, d'une variation dans le protocole expérimental (manque de reproductibilité des réactifs ou de la manipulation) ou d'une variation dans l'acquisition des données (variations de fluorescence, canaux de lecture différents, biais dans l'analyse mathématique). Il est aussi particulièrement ardu d'être certain que l'efficacité utilisée (mesurée à chaque expérience ou non) est bien celle qui a eu cours dans l'échantillon à calibrer (voir la PCR quantitative.
Le terme efficacité peut aussi avoir deux significations selon les auteurs :
- Les premiers désignent l'ordre de l'exponentielle. L'équation de la cinétique s'écrit donc :
[ADN]n = [ADN]initialexEn
- Les seconds désignent la fraction de molécule d'ADN servant effectivement de matrice. L'équation devient alors :
[ADN]n = [ADN]initialex (1 + E) n
La seconde formule favorise l'expression en pourcentage (en multipliant E par 100), mais que les deux concepts sont totalement semblables.
Cette efficacité de PCR est un élément essentiel à prendre en compte pour obtenir une mesure quantitative ou établir un protocole de PCR multiplexe, mais elle est le plus souvent négligeable pour un résultat qualitatif ou en PCR en point final.
Techniques associées à la PCR
Les sigles et les noms en anglais sont donnés entre parenthèses.
PCR multiplexe
La PCR multiplexe (multiplex PCR) est un protocole conçu pour augmenter plus d'un amplicon à la fois, par l'utilisation d'au moins trois amorces par réaction de PCR. Les produits de PCR ne seront alors compétitifs que pour la polymérase, les dNTP et , peut-être, le marqueur d'ADN. Il est aussi envisageable d'augmenter différents types d'ADN reconnus par un même couple d'amorces, tels les Modèle :Mimics. La PCR multiplexe peut se faire en point final (les produits de PCR étant habituellement différenciés par leur taille ou la présence d'un site de restriction) ou en temps réel (chaque produit étant mesuré par une sonde spécifique couplée à un fluorophore dont le spectre d'émission est différent des autres). Ses applications qualitatives sont nombreuses (détection de souche virale, de mutations, …) mais son aspect quantitatif ne fait pas l'unanimité, malgré de fortes pressions industrielles pour ce marché particulièrement lucratif.
La PCR emboîtée, PCR gigogne ou PCR nichée (Nested PCR) est une PCR en deux étapes successives, avec deux couples d'amorce différents, le second liant des séquences localisées à l'intérieur du premier amplicon. Cette technique était originellement utilisée pour diminuer le risque de contamination (le produit final devait pouvoir interagir avec deux couples d'amorces, par conséquent deux niveaux de spécificité). Elle est désormais particulièrement utilisée par les virologues œuvrant sur les virus à ARN qui peuvent avoir une haute mutabilité. Le premier couple d'amorces est conçu pour pouvoir accrocher les quelques parties stables du génome viral, le deuxième pour identifier le sous-type. Elle permet aussi une meilleure sensibilité du résultat.
PCR asymétrique
C'est l'augmentcation par PCR en présence d'une faible quantité d'une des amorces. Elle permet le séquençage direct des fragments augmentés. Pendant les 20 à 25 premiers cycles, l'ADN double brin est généré, jusqu'à épuisement de l'amorce limitante et de l'ADN simple brin est produit pendant les 5 à 10 derniers cycles. Les rapports d'amorces utilisés sont de 50 pmole/1-5 pmoles/100 µL (1-3 pmoles simple brin après 30 cycles).
PCR à asymétrique thermique entrelacée
La PCR à asymétrique thermique entrelacée (TAIL-PCR ou Thermal asymmetric interlaced PCR) est un protocole complexe alliant les principes de la PCR emboîtée, de la PCR asymétrique par le Tm des amorces, la succession de plusieurs types de cycle facilitant l'hybridation de telle ou telle amorce, et des amorces dégénérées. L'objectif est d'obtenir un amplicon final spécifique d'une séquence d'ADN dont seule une extrémité est connue le plus souvent dans l'optique de séquencer la partie inconnue. Cette méthode est particulièrement utilisée pour la marche sur chromosome ou la caractérisation des séquences variables des immunoglobulines.
PCR en gradient de température
Il s'agit d'une technique aidant à la mise au point d'un nouveau protocole de PCR. Elle nécessite des thermocycleurs capables d'assurer des températures différentes, pour une même étape, aux divers échantillons. Elle est en particulier utilisée pour optimiser l'étape d'hybridation, surtout en PCR multiplexe.
PCR en temps réel ou PCR quantitative
La PCR en temps réel (Real-time PCR) est une révolution dans l'utilisation de la PCR, cette technique consiste à mesurer la quantité d'ADN polymérisé à chaque cycle (temps réel) grâce à un marqueur fluorescent. Elle permet par son principe de faire des mesures quantitatives (expliquant l'appellation PCR quantitative, qPCR) mais elle nécessite des thermocycleurs spécifiques. Il ne faut en particulier pas la confondre avec la RT-PCR (Reverse Transcription PCR), on préférera par conséquent les appellations PCR quantitative ou qPCR. Certaines expériences en PCR compétitive ou PCR radioactive permettent l'obtention de mesure quantitative exploitable. [réf. souhaitée]
PCR en point final
La PCR en point final (end point PCR) est un terme qui est apparu en opposition à la PCR en temps réel. Il sert à désigner l'ensemble des tentatives de quantification à partir du produit final d'une réaction de PCR.
PCR par essais
La PCR par essais (Touchdown PCR) est un protocole utilisé pour augmenter de l'ADN faiblement représenté et/ou subissant une compétition sur leurs amorces par des produits de pseudo-gène. Il consiste à avoir une température d'hybridation particulièrement haute lors des premiers cycles afin d'assurer une forte stringence et par conséquent une augmentcation spécifique. Une fois que la séquence d'intérêt devient majoritaire vis-à-vis de ses compétiteurs, la température d'hybridation est progressivement abaissée afin d'assurer une meilleure efficacité de PCR. L'efficacité n'étant pas constante tout au long de la réaction, il est particulièrement complexe (impossible ?) de pouvoir obtenir un résultat quantitatif sans biais.
PCR sur colonie
La PCR sur colonie (Colony PCR) est un protocole qui permet d'augmenter de façon simple de l'ADN de micro-organisme (bactéries, archées ou levures) en inoculant directement la colonie dans le milieu réactionnel de la PCR. Durant les premières étapes de dénaturation, les cellules sont lysées et leur ADN est libéré dans le milieu réactionnel. L'ADN ainsi libéré peut alors servir de matrice.
La PCR sur colonie est utilisée surtout pour vérifier l'efficacité d'une transgénèse. Elle fut particulièrement utilisée lors de la construction des BAC dans les grands programmes de séquençage.
La PCR sur colonie est beaucoup utilisée en recherche microbiologique pour caractériser sur le plan phylogénétique les souches étudiées.
Aprés
RT-PCR
La RT-PCR (Reverse Transcriptase PCR) est une technique qui associe une (RT) suivie d'une PCR. Elle sert à synthétiser le brin complémentaire d'un ARN avec des désoxyribonucléotides en utilisant une ADN polymérase ARN dépendante (). Cet ADNc est le plus souvent conçu pour être augmenté par PCR (l'ADNc étant plus stable, il permet plus de liberté que les ARN pour les analyses suivantes).
RT-PCR en une étape
La RT-PCR en une étape (single step RT-PCR) est un protocole mélangeant les réactifs de RT et de PCR pour que les deux étapes puissent se faire sans avoir à ouvrir le tube. Cela sert à diminuer le risque de contamination ou d'inversion d'échantillon mais il est plus complexe d'optimiser le milieu réactionnel pour chaque étape. Cela induit en outre un risque de biais pour normaliser l'étape de RT car cela implique d'utiliser la PCR multiplexe.
RT-PCR in situ
La RT-PCR in situ est une méthodologie consiste à réaliser la RT-PCR non pas sur des molécules en solution mais sur des coupes histologiques. Quoique les résultats ne soient que semi-quantitatifs, ils apportent en outre une information sur la localisation des transcrits dans le tissu.
RT-PCR quantitative
La RT-PCR quantitative (qRT-PCR) est une technique conçue pour pouvoir quantifier un type d'ARN originellement présent dans un échantillon. Ce terme sert à désigner l'utilisation de deux techniques successivement, une Transcription inverse suivie d'une PCR en temps réel. Objectif principal de la majorité des biologistes, elle soulève de vives polémiques quant à l'utilisation de calibrateur externe ou interne (gène de ménage). À l'exception de complexes protocoles utilisant des calibrateurs externes homologues compétitifs, elle ne permet qu'une quantification relative.
RT-PCR sur une cellule
La RT-PCR sur une cellule (single-cell RT-PCR) est une méthodologie qui permet d'étudier les transcrits d'une cellule unique, obtenue par patch-clamp, microdissection laser ou triage de cellules par activité de fluorescence (FACS en anglais pour Fluorescence activated cell sorting). Cette précision peut être indispensable quand le tissu n'est pas homogène (cellules tumorales, feuillets cellulaires bien différenciés, etc. ) mais la quantification va devenir moins précise à cause d'une augmentcation des effets stochastiques et nécessite par conséquent une multiplication des mesures.
PAN-AC
Une autre technique d'augmentcation isotherme : "Polymérisation des Acides Nucléiques pour Apoptose Controlée". Les auteurs prétendent que cette technique pourrait être mise en œuvre dans des cellules vivantes, et ainsi soigner diverses pathologies (HIV, Malaria, cancers... ) [1] mais ces affirmations n'ont été corroborées par aucune autre équipe pour l'instant.
TP-PCR
La TP-PCR (TP pour Triplet Repeat primed), une variante complexe de la PCR, a été mise au point par Jon Warner en 1996 et est utilisée dans les augmentcations des gènes comportant des triplets répétés, comme dans le cas de la Dystrophie myotonique de Steinert. La combinaison PCR-Séquençage ne peut pas être utilisée dans ces cas car la Taq polymérase fait des erreurs de réplication.
Augmentcation hélicase-dépendante
L'augmentcation hélicase-dépendante (HDA ou helicase-dependent augmentcation) est une technique récente proche de la PCR, où la déshybridation induite par la température est assurée par une hélicase.
Autres techniques
|
|
Sources
- ↑ (en) F. David et E. Turlotte, «An Isothermal Augmentcation Method», dans Comptes-Rendus de l'Académie des Sciences, vol. 321, 1998, p. 909-914
Bibliographie
- (fr) Elyse Poitras et Alain Houde. La PCR en temps réel : principes et applications. Reviews in Biology and Biotechnology (Canada). Vol. 2, No 2, December 2002. pp. 2-11
- Articles anglophones
- (en) Baltimore D. RNA-dependent DNA polymerase in virions of RNA tumor viruses. 1970. Nature 226, 1209–1211
- (en) Birch DE. Simplified hot start PCR. 1996. Nature;381 :445–6.
- (en) Friedberg EC. The eureka enzyme : the discovery of DNA polymerase. Nat Rev Mol Cell Biol. 2006 Feb;7 (2) :143-7.
- (en) Higuchi R, Dollinger G, Walsh PS, Griffith R. Simultaneous augmentcation and detection of specific DNA sequences. 1992. Biotechnology;10 :413–7.
- (en) Detection of specific polymerase chain reaction product by utilizing the 5'–3'exonuclease activity of Thermus aquaticus DNA polymerase Holland PM, Abramson RD, Watson R, Gelfand DH. Proc Natl Acad Sci USA 1991;88 :7276–80.
- (en) Kornberg, A., Lehman, I. R., Bessman, M. J & Simms, E. S. Enzymatic synthesis of desoxyribonucleic acid. 1956. Biochim. Biophys. Acta 21, 197–198
- (en) Lay MJ, Wittwer CT. Real-time fluorescence genotyping of factor V Leiden during rapid-cycle PCR. 1997. Clin Chem;43 :2262–7.
- (en) Liu YG, Whittier RF. Thermal asymmetric interlaced PCR : automatable augmentcation and sequencing of insert end fragments from P1 and YAC clones for chromosome walking. 1995. Genomics. Feb 10;25 (3) :674-81.
- (en) Mullis K, Faloona F, Scharf S, Saiki R, Horn G, Erlich H. Specific enzymatic augmentcation of DNA in vitro : the polymerase chain reaction. Cold Spring Harb Symp Quant Biol. 1986;51 Pt 1 :263-73.
- (en) Saiki RK, Gelfand DH, Stoffel S, Scharf SJ, Higuchi R, Horn GT, Mullis KB, Erlich HA. Primer-directed enzymatic augmentcation of DNA with a thermostable DNA polymerase. Science. 1988 Jan 29;239 (4839) :487-91.
- (en) Stoflet ES, Kœberl DD, Sarkar G, Sommer SS. Genomic augmentcation with transcript sequencing. Science. 1988 Jan 29;239 (4839) :491-4.
- (en) Temin HM & Mizutani S. RNA-dependent DNA polymerase in virions of Rous sarcoma virus. 1970. Nature 226, 1211–1213 (1970).
- (en) Watson JD & Crick FC. A structure for deoxyribose nucleic acid. Nature. 1953 171, 737–738
- (en) Warner JP et al. A general method for the detection of large CAG repeat expansions - Journal of Medical Genetics, December 1996, Vol. 33, No 12, pp. 1022 – 1026
- (en) Wittwer CT, Herrmann MG, Moss AA, Rasmussen RP. Continuous fluorescence monitoring of rapid cycle DNA augmentcation. 1997. Biotechniques;22 :130–1, 134–8.
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 17/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité